همه چیز درباره آنزیم ها و کاربردشان
در ادامه با آنزیمها و نحوه عملکردشان آشنا میشوید. با دانشچی همراه باشید.
آنزیم چیست؟
آنزیمهاآنزیم یا کاتالیزگر مولکولهای زیستی با ساختار پیچیده هستند که نقش اساسی در تسریع واکنشهای شیمیایی درون موجودات زنده ایفا میکنند. این کاتالیزورهای زیستی با کاهش انرژی فعالسازی، سرعت واکنشها را به طور چشمگیری افزایش میدهند، بدون اینکه خود در واکنش مصرف شوند یا تغییر دائمی پیدا کنند. به عبارت دیگر، آنزیمها با فراهم کردن مسیرهای واکنش جایگزین با انرژی فعالسازی کمتر، امکان انجام واکنشها را در دماها و شرایط فیزیولوژیکی بدن فراهم میسازند.
اغلب آنزیمها ساختار پروتئینی دارند، به غیر از انواع محدودی از آنها که از جنس ریبونوکلئیک اسید هستند؛ مانند ریبوزومها. آنزیمها با پایین آوردن انرژی فعالسازی یک واکنش فعالیت میکنند.
آنزیم ها نوعی کاتالیزور آلی هستند که توسط سلول های زنده تولید می شوند. تمام آنزیم ها از جنس پروتئین هستند و از زنجیره های بلند اسیدهای آمینه تشکیل شده اند.
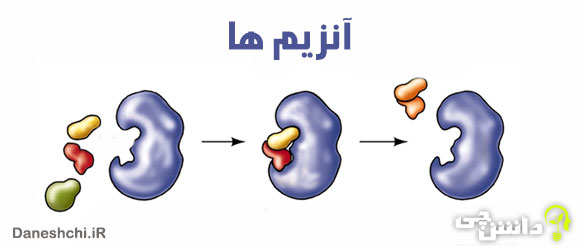
آنزیم ها بدون وارد شدن در یک واکنش، می توانند سرعت آن را زیاد کنند و پس از پایان واکنش، دست نخورده باقی بمانند. این مواد مولکول های شرکت کننده در واکنش را بطور فیزیکی با یکدیگر پیوند می دهند و آن را طوری در جای خود نگه می دارند که واکنش مورد نظر بتواند انجام بگیرد.
هر آنزیم شکل سه بعدی خاص و ساختار سطحی ویژه ای دارد. به مولکول هایی که آنزیم بر آنها اثر می کند، مولکول های پیش ماده می گویند. در سطح آنزیم ها محل هایی برای پیوند با مولکول های پیش ماده وجود دارد. به این محل ها جایگاه عمل می گویند.
دانشمندان بیش از هزار نوع آنزیم را شناسایی کرده اند. حدود ۹۰ درصد پروتئین موجود در سلول ها، آنزیم است. هر آنزیم فقط در چند واکنش و گاه فقط در یک واکنش شرکت می کند. این خاصیت آنزیم ها به شکل جایگاه عمل آنها مربوط است. جایگاه عمل هر آنزیمی شکلی معین دارد و فقط مواد خاصی را می پذیرد.
فعالیت آنزیم به غلظت پیش ماده، PH و دمای محیط بستگی دارد. افزایش دما تا ۵۰ یا ۶۰ درجه سانتیگراد سرعت عمل آنزیم ها را افزایش می دهد. ولی در دمای بالاتر از این مقدار، آنزیم خاصیت خود را از دست می دهد. در واقع دمای زیاد باعث به هم ریختن نوع آرایش مولکولی آنزیم ها می شود. برخی از مواد سمی مثل سرب، جیوه و آرسنیک عملکرد آنزیم ها را دچار اختلال می کنند.
آنزیم ها، خود از آنزیم های دیگر تشکیل شده اند. اکثر آنزیم ها برای عملکرد صحیح به کمک ماده ای دیگر به نام کوآنزیم نیاز دارند. کوآنزیم ها از مشتقات ویتامین ها ساخته می شوند.
تاریخچه آنزیم
کشف آنزیم ها در واقع به پژوهش های وسیع پاپن و پرسوز وابسته بود. آنان در سال ۱۸۳۳ موفق شدند از جو سبز شده ترکیبی را به نام مالت کشف کنند که نشاسته را به قند مبدل میساخت و این ترکیب را دیاستاز نامیدند که امروزه به نام آنزیم آمیلاز معروف است. چند سال بعد شوان برای نخستین بار آنزیم پپسین را که موجب گوارش گوشت میشد، کشف کرد و همین طور ادامه پیدا کرد اما وکونه نخستین کسی بود که آنزیم را بجای دیاستاز بکار برد.
ساختار آنزيم ها
آنزیم ها ماهیتی پروتئینی دارند و ساختار بعضی ساده یعنی از یک زنجیره پلی پپتیدی ساخته شدهاند و بعضی الیگومر هستند. ساختار بعضی از آنزیمها منحصرا از واحدهای اسید آمینه تشکیل یافته اما برخی دیگر برای فعالیت خود نیاز به ترکیبات غیر پروتئینی دارند که به نام گروه پروستتیک معروف است و این گروه میتواند یک فلز یا یک کو آنزیم باشد و با آنزیم اتصال محکمی را برقرار میکنند. بخش پروتئینی آنزیم (بدون گروه پروستتیک) آپوآنزیم نام دارد و مجموع آنزیم فعال از نظر کاتالیزوری و کوفاکتور مربوطه هولوآنزیم نام دارد.
گروه پروستتیک
گروه یا ریشه پروستتیک در بیوشیمی به ساختاری میگویند که با اتصالهای محکم به یک پروتئین متصل میشود. به عنوان مثال گروه «هِم» (به انگلیسی: Heme) در ساختار هموگلوبین یک ریشه پروستتیک است. گروه یا ریشه پروستتیک میتواند نقشهای عملکردی پروتئین را بر عهده بگیرد. به عنوان مثال گروه پروستتیک «هم» در پروتئین هموگلوبین نقش اصلی را در اتصال به اکسیژن دارد.
کوآنزیمها
ترکیبات آلی هستند که با اتصالات ضعیفی (غیر کووالانتی) به قسمت پروتئینی آنزیم متصل اند. کوآنزیمها مولکولهای غیر پروتئینی و آلی هستند که از اجزای برخی آنزیمها میباشند. آنها شامل ویتامینهای فسفوریله شدهٔ محلول در آب و برخی مولکولهای غیر ویتامینی و آلی دیگر مانند هم (در هموگلوبین و میوگلولین) میباشند.
به آنزیم بدون کوآنزیم، آپوآنزیم گفته میشود و هنگامی که کوآنزیم وارد ساختار آنزیم میشود، آنزیم کامل، هالوآنزیم نامیده میشود.
اکتیویتورها (activators) یون های فلزی هستند که با اتصالات ضعیفی به قسمت پروتئینی آنزیم متصل اند و برای فعالیت تعدادی از آنزیمها وجود آنها ضروری است.
انواع آنزیم ها
◊ آنزیم اکسیدوردوکتاز
در زیستشیمی یک اکسیدورداکتاز آنزیمی است که انتقال الکترون را از یک مولکول (احیاکننده) به مولکول دیگر (اکسیدان) کاتالیز میکند
اکسیدوردوکتازها به بیست و دو زیرگروه قابل تقسیم بندی هستند مانند EC 1.1 یا الکل اکسیدوردوکتازها و EC 1.11 یا پروکسیدازها
◊ آنزیم ترانسفراز
در زیستشیمی یک ترانسفراز آنزیمی است که انتقال یک گروه عاملی (مثل گروه متیل یا فسفات) را از یک مولکول به مولکول دیگر کاتالیز میکند.
A–X + B → A + B–X
در این مثال A دهنده و B پذیرنده است و دهنده معمولاً یک کوآنزیم است.
◊ آنزیم هیدرولاز
آنزیمی است که آبکافت (آبکافت (به انگلیسی: Hydrolysis) یک واکنش شیمیایی است که در طی آن یک یا چند مولکول آب به یونهای هیدروژن و هیدروکسیل شکسته میشود که این ممکن است باعث ادامهیافتن حضور آن در واکنشهای دیگری شود.
در واکنش آبکافت، ممکن است همراه با تجزیهٔ آب مولکولهای دیگری نیز شکسته شوند که طی آن گروه هیدروژن به یک قسمت و گروه هیدروکسیل به قسمت دیگر مولکول شکسته شده اضافه می شوند. هیدرولیز واکنشی است که در محیط آبی منجر به یونیزاسیون ماده میشود.) پیوندهای شیمیایی را کاتالیز میکند.
◊ آنزیم لیاز
آنزیمی است که شکستن پیوندهای شیمیایی مختلف را از راههایی جز آبکافت و اکسیداسیون کاتالیز میکند و اغلب باعث ایجاد یک پیوند دوگانه جدید یا یک ساختمان حلقوی میشود. برای مثال آنزیمی که تجزیه آدنوزین تری فسفات را به آدنوزین مونو فسفات حلقوی و دو فسفات کاتالیز میکند یک لیاز است.
◊ آنزیم ایزومراز
آنزیمی است که تبدیل ایزومرها را به هم دیگر کاتالیز میکند مانند آنزیم enoyl CoA isomerase و اپی مرازها. هر دو طرف واکنش ایزومراز ایزومر یکدیگرند.
◊ آنزیم لیگاز
لیگازها (Ligase) آنزیم هایی هستند که با کاتالیز ترکیب قسمت هایی از مولکول های اول با همه یا قسمت هایی از مولکول دیگر مولکولی بزرگتر می سازد و معمولاً ATP (آدنوزین تری فسفات) مصرف میکند.
خلاصه :
کوفاکتور ها شامل
۱) گروه پروستتیک
۲) کو آنزیم
۳) اکتیویتور
هستند.
آنزیم ها در ۶ گروه
۱)اکسیدوردوکتاز
۲)ترانسفراز
۳)هیدرولاز
۴)لیاز
۵)ایزومراز
۶)لیگاز
طبقه بندی می شوند.
مثالهایی از آنزيم های بدن
هزاران نوع آنزیم در بدن انسان وجود دارد، و در اینجا فقط چند نمونه از آنها به عنوان مثال ذکر خواهد شد:
• لیپازها – گروهی از آنزیمها هستند که به هضم چربیها در روده کمک میکنند.
• آمیلاز – در بزاق و لوزالمعده یافت میشود و نشاسته را به قندهای سادهتر تجزیه میکند.
• مالتاز – این آنزیم نیز در بزاق یافت میشود و قند مالتوز را شکسته به گلوکز تبدیل میکند. مالتوز در غذاهایی مثل سیب زمینی، پاستا و آبجو وجود دارد.
• تریپسین – این آنزیم در رودۀ کوچک یافت میشود و پروتئینها را شکسته به آمینو اسیدها تبدیل میکند.
• لاکتاز – این آنزیم در رودۀ کوچک یافت میشود، و لاکتوز یا قند شیر را خرد کرده به گلوکز و گالاکتوز تبدیل میکند.
• استیلکولیناستراز – این آنزیم انتقال دهندۀ عصبی استیلکولین در عصبها و عضلات را خرد و ریز میکند.
• هلیکاز – رشتههای DNA را از هم باز میکند
• پلیمراز DNA – این آنزیم DNA برگرفته از دئوکسیریبونوکلئوتیدها را سنتز میکند.
عوامل موثر بر فعالیت آنزیمها
فعالیت آنزیمها تحت تأثیر عوامل مختلفی قرار میگیرد، از جمله:
دما: افزایش دما تا حد معینی سرعت واکنش آنزیمی را افزایش میدهد، اما دمای بسیار بالا باعث تغییر شکل آنزیم (دناتوراسیون) و غیرفعال شدن آن میشود.
pH: هر آنزیم در pH خاصی بهترین عملکرد را دارد. تغییر pH محیط میتواند ساختار آنزیم را تغییر داده و فعالیت آن را کاهش دهد.
غلظت سوبسترا: افزایش غلظت سوبسترا تا حد معینی سرعت واکنش را افزایش میدهد، اما پس از اشباع شدن جایگاههای فعال، افزایش بیشتر سوبسترا تأثیری بر سرعت واکنش ندارد.
مهارکنندهها: برخی مواد میتوانند به آنزیم متصل شده و فعالیت آن را مهار کنند. مهارکنندهها میتوانند به صورت رقابتی (با سوبسترا برای اتصال به جایگاه فعال رقابت میکنند) یا غیررقابتی (به جایگاه دیگری در آنزیم متصل میشوند و ساختار آن را تغییر میدهند) عمل کنند.
کاربردهای آنزیمها در صنعت
آنزیمها در صنایع مختلف مانند صنایع غذایی، داروسازی، کشاورزی و محیط زیست کاربرد گستردهای دارند. به عنوان مثال:
صنایع غذایی: تولید شربت ذرت با فروکتوز بالا: آنزیم گلوکز ایزومراز برای تبدیل گلوکز به فروکتوز در تولید شربت ذرت با فروکتوز بالا استفاده میشود.
تولید پنیر: آنزیم رنین برای انعقاد شیر در تولید پنیر استفاده میشود.
پخت نان: آنزیم آمیلاز برای تجزیه نشاسته به قند در خمیر نان استفاده میشود که باعث بهبود کیفیت نان میشود.
صنایع داروسازی: آنزیمها در تولید داروها، از جمله آنتیبیوتیکها و داروهای ضد سرطان استفاده میشوند.
صنایع شوینده: آنزیمهای پروتئاز و لیپاز در مواد شوینده برای تجزیه لکههای پروتئینی و چربی استفاده میشوند.
صنایع کاغذ سازی: آنزیمها در صنایع کاغذ سازی برای تجزیه لیگنین و بهبود کیفیت کاغذ استفاده میشوند.
محیط زیست: آنزیمها در تصفیه فاضلاب و تجزیه آلایندههای محیطی استفاده میشوند.
تاریخچه کشف و مطالعه آنزیمها
درک ما از آنزیمها در طول قرنها تکامل یافته است. در اینجا به بررسی تاریخچه آنزیمها، از اولین مشاهدات تا پیشرفتهای مدرن میپردازیم:
قرن ۱۸: شیمیدانان اولیه متوجه شدند که عصاره معده میتواند گوشت را تجزیه کند، و بزاق میتواند نشاسته را به قند تبدیل کند. این مشاهدات اولیه نشاندهنده وجود عواملی بود که واکنشهای بیولوژیکی را تسریع میکنند.
۱۸۳۳: آنسلم پاین و ژان-فرانسوا پرسوز، دو شیمیدان فرانسوی، مادهای را از جوانه جو جدا کردند که میتوانست نشاسته را به قند تبدیل کند. آنها این ماده را “دیاستاز” نامیدند که امروزه به عنوان آمیلاز شناخته میشود.
۱۸۳۶: تئودور شوان، فیزیولوژیست آلمانی، آنزیم پپسین را از معده جدا کرد که پروتئینها را تجزیه میکند.
۱۸۷۸: ویلهلم کونه، فیزیولوژیست آلمانی، اصطلاح “آنزیم” را برای توصیف این کاتالیزورهای بیولوژیکی ابداع کرد.
اواخر قرن ۱۹ و اوایل قرن ۲۰: دانشمندان تعداد زیادی آنزیم جدید را کشف و ویژگیهای آنها را بررسی کردند. همچنین نقش حیاتی آنزیمها در فرآیندهای متابولیکی مانند تخمیر، تنفس و فتوسنتز مشخص شد.
۱۹۲۶: جیمز سامنر، بیوشیمیست آمریکایی، برای اولین بار آنزیم اورهآز را به شکل کریستالی خالص به دست آورد و نشان داد که آنزیمها ماهیت پروتئینی دارند.
دهه ۱۹۳۰: جان نورثروپ و همکارانش آنزیمهای پپسین، تریپسین و کیموتریپسین را به شکل کریستالی خالص به دست آوردند و مطالعات ساختاری را آغاز کردند.
دهه ۱۹۶۰ و ۱۹۷۰: تکنیکهای کریستالوگرافی اشعه ایکس و سایر روشهای بیوفیزیکی به دانشمندان اجازه داد تا ساختار سه بعدی آنزیمها را با جزئیات بررسی کنند و مکانیسم عمل آنها را بهتر درک کنند.
دهه ۱۹۸۰ و ۱۹۹۰: پیشرفت در زمینه بیولوژی مولکولی و مهندسی ژنتیک منجر به تولید آنزیمهای نو ترکیب با ویژگیهای بهبود یافته شد.
امروزه: آنزیمها در صنایع مختلف مانند صنایع غذایی، داروسازی، کشاورزی و محیط زیست کاربرد گستردهای دارند. همچنین تحقیقات در زمینه آنزیمها به منظور کشف آنزیمهای جدید با ویژگیهای منحصر به فرد و کاربردهای نوآورانه ادامه دارد.
حقایقی درباره آنزیم ها
آنزیم ها می توانند بارها و بارها مورد استفاده قرار گیرند.
بسیاری از داروها و سموم به صورت مهار کننده برای آنزیم ها عمل می کنند. برخی از زهرهای مار ها مهار کننده اند.
آنزیم ها اغلب کاربری های صنعتی مانند پردازش مواد غذایی، تولید کاغذ و مواد شوینده دارند.
ما یک آنزیم به نام آمیلاز در بزاقمان داریم که به تجزیه نشاسته هنگامی که غذا را می جویم کمک می کند.
آنزیم ها نقش مهمی در تجزیه غذایی که ما می خوریم دارند به طوری که بدن ما بتواند آن را مورد استفاده قرار دهد. آنزیم های خاصی وجود دارند که انواع مختلف مواد غذایی را تجزیه می کنند. آنها در بزاق، معده، لوزالمعده و روده کوچک یافت می شوند.
پیشنهادی: همه چیز درباره پروتئین ها دانشچی پورتال جامع تحقیق و مقاله، مطالب علمی و هنری ، وبگردی و…
دانشچی پورتال جامع تحقیق و مقاله، مطالب علمی و هنری ، وبگردی و…